![NEITEC - Núcleo de Estudos Industriais e Tecnológicos | Escola de Química - UFRJ [NEITEC - Núcleo de Estudos Industriais e Tecnológicos | Escola de Química - UFRJ]](http://www.neitec.eq.ufrj.br/wp-content/themes/Neitec/img/logo.png)
![NEITEC - Núcleo de Estudos Industriais e Tecnológicos | Escola de Química - UFRJ [NEITEC - Núcleo de Estudos Industriais e Tecnológicos | Escola de Química - UFRJ]](http://www.neitec.eq.ufrj.br/wp-content/themes/Neitec/img/logo.png)
[dropcap]A[/dropcap] tabela periódica padrão ainda é alvo de questionamentos, devido à quebra lógica de algumas propriedades conferida pela distribuição retangular dos elementos e coloca restrições na descrição como forma, estrutura atômica, núcleo, entre outras, como é o caso da posição dos lantanídeos e actinídeos, bem como os gases nobres, separados do restante dos elementos.Mendeleev acreditava na “Lei Periódica”, ou seja, que a natureza dos elementos dependia prioritáriamente da sua massa atômica, não valorizando as diferenças entre os valores dos elementos em sequência. Comosuas predições foram baseadas nas propriedades dos elementos e não nos tamanhos desses espaços, a maneira que Mendeleev poderia ter usado para evitar usar o sistema em linhas, era representá-lo como uma espiral e as lacunas entre os halogênios e os metais alcalinos teriam se tornado visíveis anteriormente. Com isso, foi constatado que “na realidade, a série de elementos é ininterrupta e corresponde, até certo ponto, a uma função espiral”.
No início do século XX, graças aos avanços nos estudos das propriedades mecânicas quânticas dos elementos químicos, foi descoberto que o número atômico determina as propriedades químicas em vez da massa atômica e, com isso, poderia ser utilizado como critério de organização dos elementos químicos na tabela periódica. Esse padrão corrigiu algumas falhas existentes na tabela de Mendeleev e, assim, os espaços que ainda persistiram na tabela foram preenchidos mais tarde por alguns elementos descobertos e outros sintetizados em laboratório.
Atualmente, existem inúmeras variações da tabela periódica e, dentre elas, está o modelo circular idealizado inicialmente sob a forma espiral elíptica por Chancourtois em 1862 e, posteriormente, adaptada por John D. Clark em 1949, que alocou os lantanídeos e actinídeos, antes sem espaço, para acima do boro. Nesse contexto, muitos químicos já propuseram modelos em espiral e o mais recente foi feito em 2004 pelo professor de ecologia e,pesquisador deste novo modelo, da Universidade de Oxford, na Inglaterra,Philip Stewart, denominando sua tabela de Galáxia Química. A tabela proposta por Stewart (Figura 1)procura resolver alguns problemas contidos no modelo padrão, como já mencionados, e acrescenta um novo visual às informações com base na natureza cíclica das características dos elementos químicos, que depende, principalmente, dos elétrons de valência, pois os elementos químicos na tabela periódica padrão são organizados em ordem crescente de número atômico. Com isso, muitas informações sobre os átomos que formam esses elementos podem ser obtidas utilizando a distribuição eletrônica de Linus Pauling.
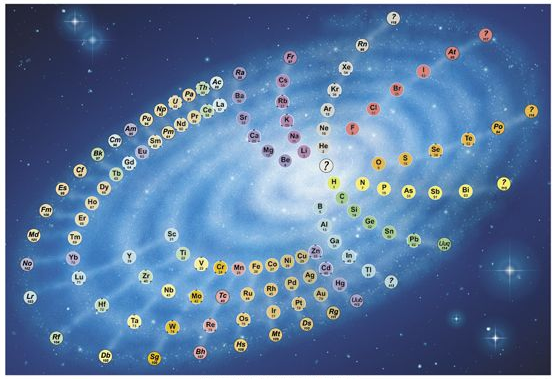
Figura 1: Galáxia Química II- Modelo proposto pelo professor da Universidade de Oxford, Philip Stewart.Fonte:ChemicalGalaxy.
Após o lançamento da primeira versão, a forma circular passou por adaptações estéticas, como por exemplo, o tamanho dos discos passou a ser proporcional aos elementos de modo que não haja sobreposição destes, a inclusão de informações como peso atômico e configurações eletrônicas, a tabela como um todo ficou mais brilhante, mais colorida e a mudança do plano de fundo de preto para azul, reforçando o design da galáxia como pretendeu Stewart, sendo então chamada de Galáxia Química II. Nesta, os elementos são dispostos em uma só espiral, de forma que aqueles com menor número atômico fiquem no centro, os raios ligam elementos de características químicas semelhantes e são usadas cores para distinguir os diferentes grupos químicos.Movendo-se no sentido anti-horário, os átomos de cada grupo doam mais um elétron à unidade formada pelos gases nobres no início da espiral (em cinza), os grupos violeta e azul, com um ou dois elétrons externos respectivamente,perdem elétrons formando cátions, os grupos laranja e vermelho, com seis e sete elétrons externos respectivamente,se tornam ânions. Por último, os átomos nos grupos ciano, verde e amarelo precisam perder ou ganhar muitos elétrons e tendem a formar ligações ao compartilhar elétrons com outros átomos.
Segundo Stewart, as linhas e colunas presentes nas tabelas são mais fáceis de ler, porém os elementos dispostos emespirais podem ser mais fáceis de lembrar.Além das espirais expressarem continuidade, são mais atraentes visualmente,facilitam uma nova colocação para o hidrogênio e hélio, que devido às propriedades químicas, oprimeiro pode se comportar ora como metal alcalino ora como halogênio e, o segundo, pode pertencer tanto ao 2º grupo (metais alcalino-terrosos) quanto aos gases nobres. Na forma circular, a posição central desses elementos os faz pertencer simultaneamente a estes grupos, desfazendo as incoerências relativas às respectivas posições na tabela peiódica padrão. Além disso, há também a introdução de um “elemento do número atômico zero”, chamado neutrônio e representado pelo ponto de interrogação por ainda ser alvo de discussões acerca de sua origem.Quanto aos lantanídeos e aos actinídeos, em vez de separados, foram incluídos na sequência principal, permitindo, por exemplo, que o lutécio e o laurêncio pertençam também aos elementos de transição.
Outro pesquisador que também tem apoiado este modelo alternativo é Mohd Abubakr, pesquisador da Microsoft Research, em Hyderabad, cuja tabela proposta está ilustrada na Figura 2. Esta forma circular da tabela preserva os períodos e os grupos utilizados por Mendeleev e reafirma a distribuição dos átomos dependente do tamanho relativo destes, iniciada pelos menores,e a posição do hidrogênio e hélio perto do centro.
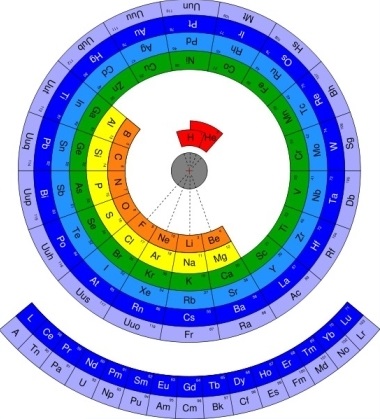
Figura 2: Modelo proposto pelo pesquisador da Microsoft, MohdAbubakr. Fonte:Abubakr (2009).
Conforme reportado por Imyanitov (2016), a sucessão linear crescente da carga nuclear dos elementos gera naturalmente a forma espiral, o que também contribui para este modelo ser considerado uma representação gráfica fundamental da Lei Periódica. Segundo o autor, o caminho inverso também pode ser obtido por corte em determinados pontos da espira, obtendo-se a tabela retangular. Após mais de 100 anos da descoberta desta Lei, estimam-se mais de mil representações gráficas do sistema periódico químico, considerando as mídias impressas e eletrônicas. Entretanto, Imyanitov relata que ainda há muita resistência por parte da comunidade científica em aceitar publicações sobre as novas tabelas ou representações alternativas do sistema periódico.
Por fim, a continuidade e fluidez das propriedades atômicas demonstradas pela forma circular da tabela periódica ratifica, analogamente, que a química em sua essência é circular e só tem a contribuir para a circularidade dos elementos presentes nos produtos, sejam estes intermediários ou finais.
No próximo artigo mergulharemos nos conceitos de economia circular e falaremos sobreos indicadores de circularidade, uma forma alternativa de suma importância que pode direcionar ações em busca deste novo modelo de sustentabilidade.
Referências:
1) Abubakr, M. An Alternate Graphical Representation of Periodic table of Chemical Elements. Disponível em: <https://arxiv.org/abs/0910.0273>.
2) A New Graphical Representation of the Periodic Table – MIT technology review. Disponível em:<https://www.technologyreview.com/s/415613/a-new-graphical-representation-of-the-periodic-table/>.
3) Galáxia Química. Disponível em: <http://www.chemicalgalaxy.co.uk>.
4) IMYANITOV, N.S. Spiral as the fundamental graphic representationof the Periodic Law. Blocks of elements as the autonomicparts of the Periodic System. Foundations of Chemistry, 18, 153-173, 2016.
5) IUPAC. Disponível em: <https://iupac.org/what-we-do/periodic-table-of-elements/>.
6) SCERRI, ERIC R.The Past and Future of the Periodic Table. American Scientist, 96, 52-58, 2008.
7) STEWART, P. J.A century on from Dmitrii Mendeleev: tables and spirals, noble gases and Nobel prizes.Foundations of Chemistry, 9:235-245, 2007.
8) STEWART, P. J.A new image of the periodic table. Education in Chemistry,41, 156-8, 2004.